Ley Combinada de los gases

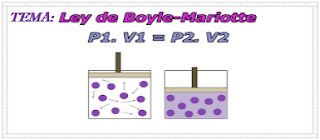
Con respecto a cada ley de los gases que se ha abordado en este bloque, se puede observar que se mantuvo constante la presión, el volumen o la temperatura, junto con la cantidad de gas; sin embargo en muchas situaciones reales esto no resulta práctico. En el caso de una muestra específica de gas, es posible relacionar las variaciones de los valores iniciales y finales de presión, volumen y temperatura mediante una sola ecuación, ecuación que combina todas las variables representadas en la ley de Boyle, ley de Charles y la ley de Gay Lussac; a esta se le conoce como ley combinada de los gases. En esta ecuación se representan seis variables diferentes. En tanto se conozcan cinco de las seis variables, se podrá determinar la cantidad faltante despejándola de la ecuación. Cabe aclarar que cuando las temperaturas T1 y T2 son iguales (constantes), se eliminan de la ecuación con lo cual esta se reduce a la ley de Boyle. Puando las presiones P1 y P2 son iguales (constantes), se eliminan ...