Ley de Charles
Contexto histórico de la ley de Charles
En 1787, el
físico francés Charles estudió la relación entre la temperatura y el
volumen de los gases. En esa época en particular el uso de globos de aire
caliente era objeto de mucha atención en Francia, y Charles fue uno de los
pioneros del ascenso en globos. Se le reconoce como el primero en emplear
hidrógeno gaseoso para inflar un globo destinado a transportar personas.
Charles, sin embargo, hizo más respecto a sus aficiones que otros entusiastas
de los globos: procedió llevar a cabo investigaciones científicas relacionadas
con el efecto de la temperatura en el volumen de un gas.
Cuando un gas
se enfría a presión constante, su volumen disminuye. Cuando el gas se calienta,
su volumen aumenta. la temperatura y el volumen son directamente proporcionales,
es decir cuando una variable aumenta la otra también aumenta o bien si una
variable disminuye la otra también lo hace. Sin embargo, está relación exige un
poco de más de reflexión. Si se calienta 1 L de gas de 100 a 200 ºC a presión
constante, el volumen no se duplica, sino que aumenta hasta aproximadamente 1.3
L. Esta relación entre el volumen y la temperatura no es tan simple como uno
quisiera debido a que una temperatura de 0 ºC, es tan solo una marca colocada
de forma arbitraria en el termómetro, en el punto de congelación del agua, la
escala de Celsius no termina en este punto cero designado; se extiende en ambas
direcciones para hacer posible la medición de temperaturas más bajas.
En sus
estudio Charles demostró que, a una presión constante, el volumen de una
muestra de gas se expande cuando se calienta y se contrae al enfriarse.
En 1848, Lord Kelvin comprendió el significado de dicho fenómeno.
Identificó la temperatura de -273.15°C como el cero absoluto, teóricamente
la temperatura más baja posible. Tomando el cero absoluto como punto de
partida estableció entonces una escala de temperatura absoluta, conocida
ahora como escala de temperatura Kelvin. En la escala Kelvin, un kelvin (K) es igual en magnitud a un grado Celsius. La única diferencia entre
la escala de temperatura absoluta y la de Celsius es la posición del cero. Los
puntos importantes de las dos escalas se comparan del siguiente modo:
En términos de la escala Kelvin, la ley de Charles se
puede expresar a través del siguiente enunciado:
El volumen de una
cantidad fija de gas mantenida a presión constante es directamente
proporcional a su temperatura absoluta.
Así, al duplicarse la
temperatura absoluta, digamos de 200 K a 400 K, hace que el volumen del
gas aumente al doble.
Lo que Charles descubrió es que si la cantidad de gas
y la presión permanecen constantes, el cociente entre el volumen y la
temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
Supongamos que tenemos un cierto
volumen de gas V1 que se encuentra a una temperatura T1 al comienzo
del experimento. Si variamos el volumen de gas hasta un nuevo valor V2,
entonces la temperatura cambiará a T2, y se cumplirá:
Esta es otra manera de expresar la
ley de Charles.
Teoría de la Ley de Charles.
La teoría
cinética molecular ofrece un modelo de lo que ocurre en el nivel molecular
durante un cambio de temperatura y volumen en una muestra especifica de gas a
presión constante. Cuando se calienta un gas, se le suministra energía, y las
partículas de gas se mueven con rapidez cada vez mayor: la masa no cambia, pero
la velocidad aumenta. Estas partículas más veloces golpean las paredes del
recipiente con mayor frecuencia. Para que la presión permanezca constante, es
necesario que el volumen del recipiente aumente, y un volumen mayor significa
que las partículas disponen de más espacio para viajar de una pared a otra.
Además al ser mayor el área de las paredes, los golpes por unidad de área serán
más frecuentes.
Para que la presión permanezca constante, el volumen del recipiente debe expandirse solo lo suficiente para compensar la energía adicional de las partículas de gas más calientes, Cuanto mayor sea la temperatura, mayor será la rapidez de las partículas de gas y el volumen que ocupen.
Ejercicio modelo de la Ley de Charles.
Un globo que está en una habitación a una temperatura de 27 ºC tiene un volumen de 2 L.¿Cuál será su volumen fuera de la habitación, donde la temperatura es de -23 ºC? (Supón que la presión no cambia; la presión atmosférica es constante?
Datos
Inicial: V1=2 L T1= 27 ºC
Inicial: V2=? T2= -23 ºC
Se deben convertir la temperatura a Kelvin sumando 273.15 a la temperatura Celsius.
T1= 27 + 273.15 = 300.15 K
T2= -23 + 273.15 = 250.15 K
La temperatura disminuye, por tanto, el volumen también debe disminuir.
Despejamos de esta ecuación V2 o bien puede plantear una regla de tres.a. - Se encuentran 8 litros de un gas ideal a 27 ºC y
presión constante. ¿Cuánto disminuye su temperatura para que su volumen sea de 5 litros?


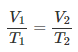


Comentarios
Publicar un comentario