Contexto Histórico de la ley de Boyle-Mariotte
En 1643, el científico italiano Evangelista Torricelli (1608-1674), al trabajar con un dispositivo de su
invención, posteriormente llamado barómetro, demostró que una columna de gas podía ejercer
presión y que ésta podía medirse. Este trabajo atrajo la atención del químico inglés Robert Boyle
(1627-1691) y lo motivó a realizar estudios precisos sobre los cambios de volumen de muestras
gaseosas causados por variaciones de presión.
En el siglo XVII, gran parte de la experimentación con gases fue motivada por el debate acerca de la existencia del vacío. La filosofía escolástica negaba la posibilidad de su existencia. Los “plenistas” (Descartes entre los más renombrados), sostenían como Aristóteles, que “la naturaleza tiene horror al vacío”.
En 1660, Boyle publicó la primera edición de su libro New Experiments Physico-Mechanical, Touching the Spring of the Aire, and its Effects (Nuevos experimentos físico-mecánicos, tocantes al muelle del aire y sus efectos) inmediatamente se publicaron dos ataques a la obra de Boyle, uno por Thomas Hobbes, el famoso filósofo político y autor de Leviatán y el otro por un devoto aristotélico, Franciscus Linus. Hobbes basó su crítica en «la imposibilidad filosófica de un vacío» («un vacío es nada y lo que es nada no puede existir»).
Boyle se propuso demostrar, sobre todo frente a las objeciones del jesuita Franciscus Linus (plenista). En respuesta a estas objeciones, Boyle incluyó en la segunda edición de su libro, publicada en 1662, un apéndice en el cual describía un nuevo en importante experimento. En dicho experimento Boyle encontró que el volumen de una muestra de gas encerrado disminuye conforme la presión externa aumenta cuando la temperatura se mantiene constante, es decir sin cambio.
En 1662 reportó los resultados de sus experimentos
llegando a la conclusión de que “el volumen de una cantidad fija de un gas a temperatura constante,
es inversamente proporcional a la presión del gas”. Este enunciado se conoce actualmente como la
ley de Boyle y puede expresarse matemáticamente como:
En términos matemáticos, se escribiría V a 1/P, el símbolo a significa es proporcional a. La expresión matemática de la ley de Boyle se lee, es proporcional a 1 sobre P. La proporción inversa se transforma en una ecuación incluyendo una constante de proporcionalidad, K.
V= K/P
Esta relación es equivalente a PV= K (a temperatura constante).
Para que el producto de P por V sea una constante, V debe disminuir cuando P aumenta y viceversa. Esta ecuación resulta útil si se considera el caso en el que una muestra específica de gas con un volumen 1 se comprime a un volumen más pequeño, V2. La presión inicial P1, aumenta a un nuevo valor, P2. Para definir las condiciones iniciales y finales se puede escribir la siguiente ecuación útil que representa la ley de Boyle.
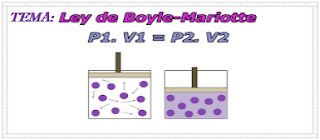
P1 . V1 = P2 . V2
Términos relacionados a la ley de Boyle
Propiedades físicas de los gases
1. los gases no tienen forma ni volumen definido. Se expanden hasta ocupar todo el volumen del recipiente que los contiene y se ajustan a su forma.
2. Los gases son compresibles, se puede hacer que un gas ocupe un volumen mucho menor aumentando la presión.
3. La densidad de los gases es pequeña en comparación con los líquidos y sólidos.
4. Los gases encerados en un recipiente ejercen una presión uniforme sobre todas las paredes del recipiente.
5. Los gases se mezclan espontánea y totalmente unos con otros a presión constate, siempre y cuando no se lleve a cabo una reacción química, Este fenómeno se llama difusión.
Presión:
La presión se
define como la fuerza que se ejerce por unidad de área.
Presión = Fuerza/Área.
Presión
atmosférica: se define como la fuerza
total que las moléculas de aire ejercen sobre cada unidad de área. Su valor
corresponde a 760 mmHg.
Ejercicio modelo de la ley de Boyle
A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
Actividad de desarrollo
1. Observa la siguiente imagen que ejemplifica la ley de Boyle
2. Explica como se cumple la ley de Boyle en la situación observada en la imagen.
Actividades de consolidación
1. Escribe dos situaciones de la vida cotidiana en donde se aplique la ley de Boyle.
2. Resuelve los siguientes ejercicios
- Un tanque de oxígeno gaseoso tiene un volumen de 5 L. la presión del gas es de 1470 lb/pulg2 a 20 ºC ¿Qué volumen ocupará el oxígeno a la presión atmosférica normal (14.7 lb/pulg2), suponiendo que la temperatura no cambia?
- Una cápsula espacial está equipada con un tanque de aire cuyo volumen es de 0.1 L. El aire está a presión de 100 atm. Después de una caminata espacial, durante la cual la presión de la cabina se reduce a cero, se cierra la cabina y se llena con el aire del tanque. ¿Cuál será la presión final si el volumen de la cápsula es de 12.5 L?
Bibliografía
Chang, Raymond Química, 7ª edición; McGraw-Hill: México, 2002.
Ralp A. Burns, Fundamentos de Química, 4ta edición; Pearson: México, 2003.




Comentarios